Técnicas de Neurorrafia: Estudio Experimental Estereológico Axonal Comparativo
INTRODUÇÃO
O trauma dos nervos periféricos é relativamente comum e sua transecção completa leva à perda de funções motoras e sensoriais (Colohan et al., 1996). Lesões derivadas ou doenças degenerativas adquiridas do sistema nervoso central também produzem sintomas periféricos (Terzis et al., 1975). Portanto, o uso de neurorrefia para retomar a função sensório-motor avançou juntamente com a evolução da compreensão da neurofisiologia, anatomia e regeneração nervosa, resultando em um nível mais efetivo de resultados obtidos com as técnicas de reparo do nervo (Yüksel et al., 1999).
Quando um nervo periférico é seccionado, a degeneração de Walleriana ocorre no coto distal, onde o axônio desintegra-se pela ação proteolítica das enzimas presentes no axoplasma. As macropagens participam da fagocitação tanto do axônio como das células de Schwann, impedindo assim a obstrução na próxima regeneração do axônio e sintetizam os fatores de crescimento nervoso (Stoll et al., 1989; Trumble, 2000).
A regeneração ocorre dependendo de fatores fisiológicos e cirúrgicos, e seu sucesso depende do comprimento do espaço causado pela lesão. Portanto, é necessário, na reconstrução de um tronco nervoso, reaproximar os cachos do nervo por neurorráfia (Hakstian, 1973; Rosegay & Edwards, 1980). O propósito desta técnica microcirúrgica é o realinhamento dos tocos nervosos com trauma cirúrgico mínimo.
Situações em que há apenas um coto distal justificam a tentativa de obter a reinervação em detrimento de um nervo saudável que não é seccionado. Esses possíveis doadores permitiram amplas opções de reconstrução anastomótica, com muitos brotos terminais de axônio que atravessavam a área de reconstrução em direção ao nervo ferido. Os fatores neurotrofícos, que a maioria é derivada das células alvo, são essenciais para o crescimento e atingem o axoplasma intacto pelo transporte retrógrado. Portanto, este trabalho tem como objetivo realizar um estudo axonal experimento estéológico de pós-neurorrorfias de lado a lado e de lado a lado para comparar a densidade volumétrica dos axônios, endouneuro e bainha de mielina (e massa muscular) nos nervos fibular e tibial, com Anastomose de contato entre 0,25 cm e 0,50 cm.
MATERIAIS E MÉTODOS
Utilizamos 20 ratos Wistar machos, variedade albinus, com peso entre 300 e 350 g, com média de 20 semanas do centro de animais de laboratório da Faculdade de Medicina de São José do Rio Preto FAMERP. Os experimentos obedeceram aos Princípios Éticos para Experimentação Animal estabelecidos pelo Colégio Brasileiro de Experimentação Animal (BCAE), aprovado pelo Comitê de Ética em Experimentação (FAMERP – Escola de Medicina de São José do Rio Preto) (Protocolo 0554-2009).
Os animais foram divididos em quatro grupos, G1 (neurorrefia do extremo a lado), G2 (neurorrefia do lado a lado com sutura de 0,25 cm), G3 (neurorrefia lado a lado com sutura de 0,50 cm) e G4 ( Controle denervado). Cada grupo é composto por cinco ratos.
Os ratos foram anestesiados com xilazina e cetamina a uma dose de 0,1 ml / 100 g, respectivamente, por via intramuscular, e depois que os ratos foram posicionados ventricamente para tricotomia em toda a parte posterial da região glútea, onde a região glútea de cada grupo foi operada e Mantido sob observação por seis meses.
O procedimento de avaliação da neurorrefia foi realizado por um estudo controlado totalmente aleatorizado, onde uma incisão longitudinal de aproximadamente 4 cm foi feita para expor o nervo ciático e seus ramos (fibular, tibial e sural). O nervo fibular dos quatro grupos (G1, G2, G3 e G4) foi seccionado para obter dois tocos, um proximal e distal. Em G1 (neurorrefia de ponta a ponta), o coto proximal foi inclinado para a mediana e enterrado dentro do músculo adutor. O coto distal foi suturado no nervo tibial sem a remoção do epineuro, com a extremidade suturada de um lado a outro (Fig. 1). Em G2 (neurorrefia de lado a lado com sutura de 0,25 cm) e em G3 (neurorrefia de lado a lado com sutura de 0,5 cm), o coto proximal foi dobrado e enterrado internamente dentro do músculo glúteo, e o tronco distal foi Lateralmente curvado com a extremidade enterrada no músculo adutor. Estes procedimentos foram realizados para manter a maior distância possível (1 cm) entre o coto proximal e distal. Em seguida, realizamos de lado a lado 0,25 cm e 0,50 cm e sem remoção do epineuro entre o nervo fibular e tibial (Figuras 2 e 3). Para medir a sutura de 0,25 e 0,5 cm, utilizamos a pinça DBMCO ALEMANHA STAINIES. Em G4 (controle denervado), o coto proximal foi dobrado e suturado ao músculo adutor e ao coto distal ao músculo tibial craniano (Fig. 4). Este grupo foi usado como um grupo de controle de desnervação. Todos os membros esquerdos foram usados como um grupo de controle normal. O procedimento de neurorrefia foi realizado com o auxílio de 6x lentes BIOART bi-oculares.
Os ratos foram alojados em gaiolas apropriadas no centro de animais de laboratório FAMERP, separados por grupo e recebendo o mesmo cuidado com alimentos comerciais e água ad libitum, com iluminação controlada e uma temperatura média de 24 ° C (± 0,5). Após um intervalo de 6 meses, os ratos foram sacrificados e os músculos tibiais cranianos e os nervos tibial e fibular foram coletados para estudo histológico e estereológico.
Para a técnica histológica, os fragmentos de nervos tibulares e fibulares foram fixados em 10% de formaldeído e incorporados em parafina. Eles foram então transversalmente cortados 0,5 mm de espessura e corados com Masson Trichrome. Os músculos tibiais cranianos foram removidos e pesados em uma escala de precisão. Os parâmetros estereológicos considerados para o estudo dos nervos tibial e fibular (axônios, endoneuros e bainha de mielina) foi a densidade volumétrica. Para a compilação de dados estereológicos, o software Image Pro Plus versão 6.0 foi utilizado.
Utilizamos o teste não paramétrico de Mann-Whitney para avaliação estatística de dados quantitativos, a fim de verificar a densidade do volume dos nervos tibiais e fibulares e da massa muscular dos músculos tibiais cranianos entre os grupos, adotando um nível de significância de 5%.
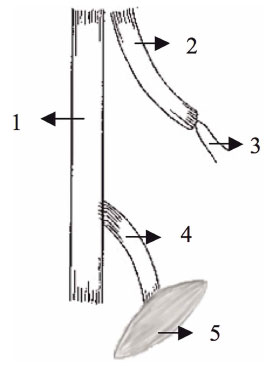
FIG. 1. G1: neurorrorfia de ponta a ponta. 1 = nervial tibial
2 = coto proximal de nervo fibular, 3 = músculo adutor,
4 = Coto distal do nervo fibular, 5 = nervo tibial craniano.
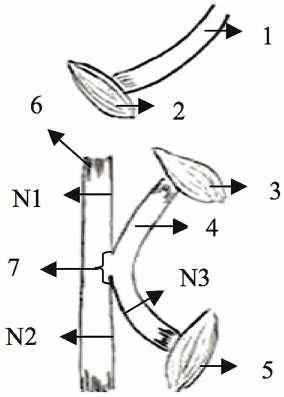
FIG. 2. G2: neurorrorfia de lado a lado com sutura de 0,25 cm. Onde N1, N2 e N3 são locais de corte para fabricação de lâminas histológicas. 1 = Coto proximal do nervo fibular, 2 = Músculo Gluteus, 3 = Músculo adutor, 4 = Coto distal do nervo fibular, 5 = Músculo tibial craniano, 6 = nervo tibial, 7 = local da neurorráfia lado a lado (0,25 cm) .
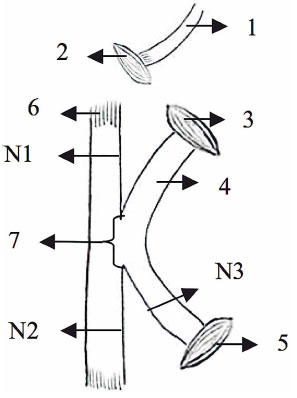
FIG. 3. G3: neurorrorfia de lado a lado com sutura de 0,5 cm. Onde N1, N2 e N3 são locais de corte para fabricação de lâminas histológicas. 1 = Coto proximal do nervo fibular, 2 = Músculo Gluteus, 3 = Músculo adutor, 4 = Coto distal do nervo fibular, 5 = Músculo tibial craniano, 6 = nervo tibial, 7 = local da neurorráfia lado a lado (0,50 cm) .
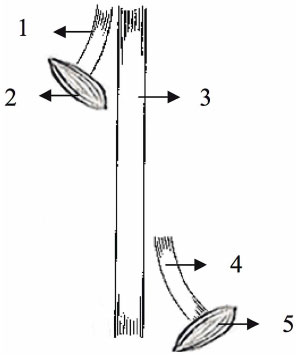
FIG. 4. G4: grupo controle de desnervação. 1 = coto proximal de nervo fibular
2 = músculo glúteo, 3 = nervo tibial, 4 = coto distal do nervo fibular, 5 = músculo tibial craniano.
RESULTADOS
As porcentagens de incidentes incidentes sobre o axônio, o endoneúrio e a bainha de mielina dos nervos tibial e fibular de cada grupo foram analisadas, os resultados são apresentados nas Tabelas I e II e a massa muscular do músculo tibial craniano na Figura 5.
Os dados estatísticos foram obtidos para os grupos de neurorrefia (G1: neurorrefia do lado a lado, G2: neurorrefia de lado a lado com sutura de 0,25 cm e G3: neurorrefia do lado a lado com sutura de 0,5 cm), mostrou que havia Significância entre axônios, endoneúrio e mielina dos nervos tibiais (p = 0,0079), exceto o endoneúrio de G1 e a bainha de mielina de G2 e G3, sem diferença estatística significativa. As cirurgias em G1, G2 e G3 dos nervos fibulares (axônios, endoneurium e bainha de mielina) não mostraram diferença estatística entre os grupos.
Uma comparação da densidade média de volume do nervo fibular mostrou uma redução significativa no número de axônios e bainhas de neurorrefia de ponta a lado (G1), neurorrorfia de lado a lado com sutura de 0,25 cm (G2) e lado-a-lado Neurofafia lateral com sutura de 0,5 cm (G3) em comparação com o grupo de controle da desnervação (G4), com apenas neurorrafia lado a lado 0,50 cm do axônio e neurorrefia lado a lado 0,25 cm da bainha de mielina com menor pontuação, No entanto, a densidade média do volume do número de endoneúrio não apresentou reduções significativas (Fig. 6).
A comparação da média feita no nervo tibial mostrou uma redução significativa da densidade volumétrica do número de axônios com neurorrorfia de ponta a ponta (G1), neurorrefia lateral com sutura de 0,25 cm (G2) e lado- A neurorrefia de neurorráfia do lado a lado com sutura de 0,5 cm (G3), quando comparada com o grupo de controle denervado (G4), com apenas neurorrafia lado a lado de 0,50 cm com menor pontuação, no entanto, a densidade média do volume dos números Do endoneurium não apresentaram reduções significativas. Em relação à densidade do volume da bainha de mielina, a neurorrorfia de ponta a cara apresentou maior média aritmética em relação ao grupo controle, enquanto que a neurorrorfia lado a lado de 0,50 cm mostrou similaridade com o grupo controle. Apenas destacamos a neurorrefície lado a lado de 0,25 cm quando comparada com o grupo controle (Fig. 7).
Na avaliação da massa muscular (Fig. 6), o grupo de controle (G4) foi dividido em G4N (grupo de controle normal) e G4D (grupo de controle de desnervação) para comparações com outros grupos. Portanto, o grupo de neurorráfia de ponta a ponta (G1) quando comparado com o grupo de controle normal (G4N) mostrou diferença estatística significante (p = 0,2222). Também podemos observar algumas diferenças quando o G2 e o G3 foram comparados com o grupo de controle normal (G4N) e o grupo de controle de desnervação (G4D) com (p = 0,0079), e houve diferença entre G4N e G4D. Levando em consideração essas distinções, os valores entre G1 e G4N são os mais pequenos.
Tabela I. Porcentagem de pontos de incidência sobre o axônio,
Bainha de endoneurio e mielina do nervo tibial.
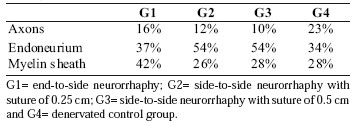
Tabela II. Porcentagem de pontos de incidência sobre o axônio,
Endoneurium e bainha de mielina do nervo fibular.
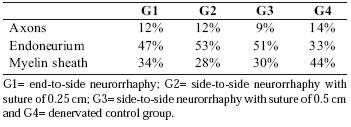
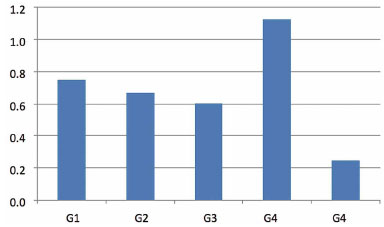
FIG. 5. Média aritmética do músculo tibial craniano em todos os grupos.
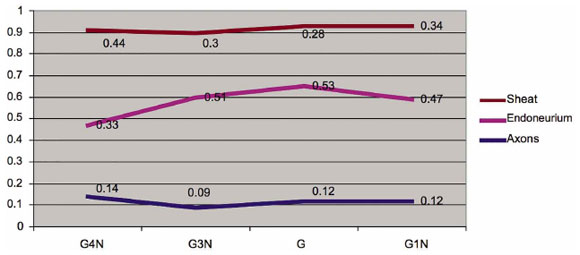
FIG. 6. Comparação da média aritmética da densidade volêmica dos axônios,
Endoneurium e bainha de mielina do nervo fibular.
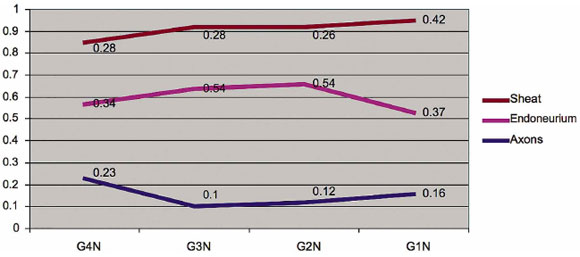
FIG. 7. Comparação da média aritmética da densidade volêmica dos axônios,
Bainha de endoneurio e mielina do nervo tibial.
DISCUSSÃO
Para a regeneração do nervo, fatores múltiplos devem ser considerados como um meio apropriado para suportar o crescimento do axônio e a capacidade de regeneração dos neurônios após a lesão. Além disso, os componentes não-neurais são os mais importantes no processo regenerativo. Eles organizam a área lesada, direcionam o crescimento axonal e produzem fatores de crescimento (Silva & Camargo, 2010). A falta de estimulação nervosa para o órgão alvo leva a alterações degenerativas, que podem ser horas extraordinárias irreversíveis. Durante este período, podemos notar o desaparecimento das placas de extremidade motora e como conseqüência, atrofia muscular, e depois disso, fibrose. Com base nesses fatos, uma reinervação em um máximo de três meses após o trauma é recomendado (Fawcett & Keynes, 1990; Mazzer et al., 2008).
A neurorrorfia de ponta a ponta é a técnica de escolha quando há proximidade dos cotos proximal e distal, uma vez que seus resultados são melhores para a regeneração. No entanto, existem situações em que o acesso a um dos tocos é difícil e geralmente leva a alguns resultados promissores devido ao estresse causado pela sutura. Viterbo (1993) introduziu a neurorrefia de ponta a lado sem lesão do nervo doador ou qualquer dano e relatou que houve um crescimento axonal do nervo intacto em direção ao tronco distal do nervo receptor. As neurorrorfias de ponta a ponta com neurectomia parcial foram testadas, no entanto, o crescimento no nervo saudável pode causar fibrose e interromper a passagem da estimulação nervosa (Mennen, 2004).
O resultado mostrou que a neurorrefia realizada em G1 (neurorrefia de ponta a ponta), semelhante à recomendada por Viterbo (1993), obteve resultados satisfatórios, confirmando os achados desses pesquisadores. No entanto, Souza et al. (2011) realizaram neurorrafia de ponta a lado com e sem a presença de janela epineural, considerando as menores diferenças e, além disso, concluiu que essas técnicas não promovem remyelinação suficiente. Para contornar a possível contaminação do tronco do motor distal para o crescimento de brotos axonais provenientes do coto proximal, a extremidade do tronco proximal do nervo fibular foi inserida no músculo adjacente, como recomendado por Viterbo et al. (1993, 1994) e Kalliainen et al. (1999), portanto, seria impossível invalidar os resultados.
Os pesquisadores concordam que a sutura epineural é fácil e simples de realizar, exigindo um menor número de pontos, o que reduz o trauma causado ao tecido nervoso (Sawamura & Abe, 1997; Dourado, 2002; Silva Neto, 2003). De fato, tanto a sutura lado a lado com 0,25 cm como 0,50 cm, não mostrou diferenças significativas entre eles, distinguindo apenas o tamanho da área de contato com o nervo saudável. É possível inferir que há uma certa independência do tamanho da área de contato e uma dependência do tamanho da sutura.
A presença de axônios regeneradores foi observada, embora em menor número e sem a realização da janela epineural. Além disso, havia uma presença de fibras nervosas e células de Schwann com aparência degenerativa, que se acredita serem remanescentes da degeneração de Waller após trauma. Este tipo de degeneração cria um ambiente favorável para o desenvolvimento axonal a partir da presença de fatores neurotróficos ao longo do coto distal (Da Silva, 1995; Ide, 1996; Thanos et al., 1998). Fu & Gordon (1997) sugeriram que esses efeitos também poderiam ocorrer por via paracrina ou autocrina em células não sensoriais do coto distal e não por efeitos diretos na regeneração axônica, que foi investigada em lâminas histológicas de locais distal da coaptação do nervo receptor . Houve presenças de brotação axonal secundária para a área prejudicial, sem qualquer correlação positiva entre essas lesões ou mesmo um maior número de fibras mielinizadas.
Em estudo experimental estereologicamente comparativo entre neurorrefícios, a densidade volêmica dos axônios, endoneúria e bainha de mielina dos nervos tibial e fibular são similares à massa muscular pós-cirúrgica, que permanece a mesma em neurorrefeições de lado a lado e de lado a lado, Independentemente da área de contato da anastomose.
Podemos inferir que, tanto a neurorráfia de ponta a ponta que se recupera e evita a atrofia da placa final do motor como uma neurorrefia de lado a lado que é independente da distância entre os tocos do nervo são as opções de reparo cirúrgico.
As neurorrefícios de lado a lado são independentes da distância entre os tocos e foram recomendadas como alternativas viáveis e enxertos nervosos (Sanapanich et al., 2002), uma vez que podem promover a recuperação sensorial como motor (Xiong et al., 2003) . Nesta técnica, um grande número de brotos axonais pode atravessar a área da sutura e promover o papel dos fatores neurotróficos para o crescimento axonal com resultados semelhantes aos das neurorreferias de ponta a ponta. A ausência de seção cirúrgica do nervo intacto minimiza os riscos relacionados à disfunção no tecido alvo, a atrofia neural e a formação de neuroma indiferenciado, associada à dor local (Sato, 2005).
REFERÊNCIAS
Colohan, A. R.; Pitts, L. S. & Rosegay, H. Injury to the peripheral nerves. In: Feliciano, D. V.; Moore, E. E. & Mattox, K. L. (Eds.). Trauma. 3rd ed. Stamford, Appleton & Lange, 1996.
Da Silva, C. F. Biologia celular e molecular da regeneração nervosa do sistema nervoso periférico. Atual. Neurociênc., 1(1):1-16, 1995.
Dourado, E. Reparación Microquirúrgica del nervio facial de conejo. Estudio comparativo de la sutura epineural y el sistema adhesivo de fibrina. Tesis de Doctorado en Odontología. Barcelona, Departamento de Ciencias Morfológicas y Odontoestomatología, Universidad de Barcelona, 2002.
Fawcett, J. W. & Keynes, R. J. Peripheral nerve regeneration. Annu. Rev. Neurosci., 13:43-60, 1990.
Fu, S. Y. & Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol. Neurobiol., 14(1-2):67-116, 1997.
Hakstian, R. W. Perineural neurorrhaphy. Orthop. Clin. North Am., 4(4):945-56, 1973.
Ide, C. Peripheral nerve regeneration. Neurosci. Res., 25(2):101-21, 1996.
Kalliainen, L. K.; Cederna, P. S. & Kuzon, W. M. Jr. Mechanical function of muscle reinnervated by end-to-side neurorrhaphy. Plast. Reconstr. Surg., 103(7):1919-27, 1999.
Mazzer, P. Y.; Barbieri, C. H.; Mazzer, N. & Fazan, V. P. Morphologic and morphometric evaluation of experimental acute crush injuries of the sciatic nerve of rats. J. Neurosci. Methods, 173(2):249-58, 2008.
Mennen, U. End-to-side nerve suturing technique. J. Hand Surg. Br., 29(5):514, 2004.
Rosegay, H. & Edwards, M. S. The language of neurorraphy. J. Neurosurg., 52(1):143-4, 1980.
Sanapanich, K.; Morrison, W. A. & Messina, A. Physiologic and morphologic aspects of nerve regeneration after end-to-end or end-to-side coaptation in a rat model of brachial plexus injury. J. Hand Surg. Am., 27(1):133-42, 2002.
Sato, K. M. Comparação de neurorrafias término-terminais e término-laterais na reconstrução do nervo mediano: pesquisa experimental em ratos Wistar adultos. Monografia. Florianópolis, Universidade Federal de Santa Catarina, 2005.
Sawamura, Y. & Abe, H. Hypoglossal-facial nerve side-to-end anastomosis for preservation of hypoglossal function: results of delayed treatment with a new technique. J. Neurosurg., 86(2):203-6, 1997.
Silva, C. K. & Camargo, E. A. Mecanismos envolvidos na regeneração de lesões nervosas periféricas. Rev. Saude Pesqui., 3(1):93-8, 2010.
Silva Neto, J. C. Estudo clínico e histopatológico do uso de gangliosídeos na regeneração nervosa em ratos após axonotmesis. Dissertação de Mestre em Odontologia. Camaragibe, Faculdade de Odontologia de Pernambuco, Universidade de Pernambuco, 2003.
Souza, F. I.; Santos, G. B.; Silva, C. F.; Junior, R. M. & Zumiotti, A. V. Avaliação histológica da neurorrafia término-lateral: estudo experimental em ratos. Acta. Ortop. Bras., 19(3):129-31, 2011.
Stoll, G.; Griffin, J. W.; Li, C. Y. & Trapp, B. D. Wallerian degeneration in the peripheral nervous system: participation of both Schwann cells and macrophages in myelin degradation. J. Neurocytol., 18(5):671-83, 1989.
Terzis, J.; Faibisoff, B. & Williams, B. The nerve gap: suture under tension vs. graft. Plast. Reconstr. Surg., 56(2):166-70, 1975.
Thanos, P. K.; Okajima, S. & Terzis, J. K. Ultrastructure and cellular biology of nerve regeneration. J. Reconstr. Microsurg., 14(6):423-36, 1998.
Trumble, T. E. Peripheral nerve injury: pathophysiology and repair. In: Feliciano, D. V.; Moore, E. E. & Mattox, K. L. (Eds.). Trauma. 2nd ed. São Paulo, Guanabara Koogan, 2000.
Viterbo, F. A new method for treatment of facial palsy: the cross-face nerve transplantation with end-to-side neurorraphy. Rev. Soc. Bras. Cir. Plast. Estet. Reconstr., 8(1-2-3):29-38, 1993
Viterbo, F.; Trindade, J. C.; Hoshino, K. & Mazzoni Neto, A. End-to-side neurorrhaphy with removal of the epineurial sheath: an experimental study in rats. Plast. Reconstr. Surg., 94(7):1038-47, 1994.
Xiong, G.; Ling, L.; Nakamura, R. & Sugiura, Y. Retrograde tracing and electrophysiological findings of collateral sprouting after end-to-side neurorrhaphy. Hand Surg., 8(2):145-50, 2003.
Yüksel, F.; Karacaoglu, E. & Güler, M. M. Nerve regeneration through side-to-side neurorrhaphy sites in a rat model: a new concept in peripheral nerve surgery. Plast. Reconstr. Surg., 104(7):2092-9, 1999.
CAPÍTULOS PUBLICADOS
1. Viterbo, F.; FALEIROS, H. R. P. . Técnicas de Neurorrafia. In: Melega, J. M. (Org.). Cirurgia Plástica Fundamentos e Arte I. Princípios Gerais. Rio de Janeiro: Medsi, 2002, v. , p. 477-484.
2. Viterbo, F.; Antonio de Castro Rodrigues ; FALEIROS, H. R. P. . Inervação da Face. In:Petroyanu, A. (Org.). Anatomia Cirúrgica. Rio de Janeiro: Guanabara Koogan, 1999, v. , p. 128-140.
3. FALEIROS, H. R. P., Viterbo, F. Princípios de Microcirurgia. In:Cataneo, A.J.M.; Kobayasi, S.. (Org.). Clínica Cirúrgica. São Paulo: Revinter, 2003, v., p. 712-721.
RESUMOS PUBLICADOS EM ANAIS DO CONGRESSO
1. Neto, M. A. ; Fausto ; Palhares A. ; FALEIROS, H. R. P. ; Bertoz, F. A. ; Ferrari, L. E. C. . Colar Cervical para Tração Anterior da Face. In: IV Congresso Brasileiro de Cirurgia Craniomaxilofacial, 1998, Porto Alegre. Colar Cervical para Tração Anterior de Face, 1998.
2. Geraldo R. Rodrigues ; Paulo do Nascimento Jr ; Ubirajara A. Teixeira ;
FALEIROS, H. R. P. . Síndrome de Abstinência Após Sedação por Período Prolongado com Morfina e Fentanil. Relato de Caso.. In: 44Congresso Brasileiro de Anestesiologia, 1997, Belo Horizonte. Síndrome de Abstinência Após Sedação por Período Prolongado com Morfina e Fentanil. Relato de Caso., 1997.
3. Kubo, M. Y. ; Roberto Carlos Burini ; FALEIROS, H. R. P. . Redução da Pressão Arterial Mediante Programa de Exercício Físico Periodizado. In: XVIII Jornada Científica da Associação dos Docentes do Campus de Botucatu – UNESP, 1993, Botucatu. XVIII Jornada Científica da Associação dos Docentes do Campus de Botucatu – UNESP, 1993.
APRESENTAÇÕES DE TRABALHO
1. FALEIROS, H. R. P.. AS ALTERNATIVAS CIRÚRGICAS NA SÍNDROME DE MOEBIUS. 2015. (Apresentação de Trabalho/Congresso).
2. FALEIROS, H. R. P.. RECONSTRUÇÃO PLÁSTICA EM ONCOLOGIA. 2015. (Apresentação de Trabalho/Simpósio).
LINHAS ATUAIS DE PESQUISA
1. Reconstruções faciais com retalhos
2. Oncologia cutânea – prevenção
3. Tecnologia da informação e telemedicina
DEMAIS TIPOS DE TÉCNICAS
1. FALEIROS, H. R. P.. Cirurgia de prótese glútea, Biarritz, França, 2011.

